
En determinadas ocasiones, los químicos describen el látex como una dispersión coloidal que permanece estable; es decir, las partículas que conforman la dispersión no se depositan ni se creman con el tiempo. Esto se logra mediante una combinación de..
En determinadas ocasiones, los químicos describen el látex como una dispersión coloidal que permanece estable; es decir, las partículas que conforman la dispersión no se depositan ni se creman con el tiempo. Esto se logra mediante una combinación de estabilización iónica y estérica. Siga leyendo para comprender cómo funcionan estos dos mecanismos únicos.
La palabra “látex” es un término cuya raíz etimológica proviene del latín y significa, literalmente, “líquido”. A principios del siglo XIX, cuando se incorporó oficialmente al idioma inglés, el látex hacía referencia a un líquido específico: la excreción blanca lechosa que se halla en el árbol del caucho y otras especies vegetales similares. El látex más común es la leche, una proteína dispersa en agua.
Actualmente, el látex describe el tipo natural y los tipos sintéticos que se fabrican mediante un proceso denominado polimerización. Al mismo tiempo, los científicos definen el látex con mayor precisión como una dispersión coloidal. La mayor parte del látex sintético está conformado por partículas poliméricas, cuyo diámetro habitual es de unos cientos de nanómetros, dispersas en agua. Se considera que toda la dispersión es coloidalmente estable, lo que significa que puede permanecer inalterada sin que las partículas se depositen ni se cremen con el tiempo.
Para comprender por qué el látex se comporta de esta manera, debemos definir el término “coloidalmente estable”. ¿Qué es un coloide? ¿Qué es la estabilización y cómo contribuye al proceso de fabricación de los productos de látex que vemos diariamente, como pinturas, adhesivos y aglutinantes?
Un curso intensivo sobre coloides
Un coloide es un tipo de mezcla que involucra dos fases: una fase continua (el medio de dispersión) y una fase dispersa (las partículas). El tamaño de las partículas de la fase dispersa, generalmente, varía de 1 nanómetro (1 milmillonésima parte de un metro, o la distancia desde el centro de un átomo de oxígeno a un átomo de hidrógeno en agua) a 1 micrómetro, con partículas de látex cuyo diámetro varía de 100 a 300 nanómetros. Existen diferentes tipos de dispersiones coloidales:
- Un sólido disperso en un líquido, también denominado suspensión, dispersión o emulsión.
- Un líquido disperso en otro líquido.
- Un gas disperso en un líquido.
- Un líquido disperso en un gas.
- Un sólido disperso en un gas.
En cualquiera de estas dispersiones, las partículas coloidales no permanecen estacionarias. Se desplazan en un patrón aleatorio, denominado movimiento browniano. A medida que se desplazan, pueden chocar entre sí, y estos choques pueden provocar una aglomeración que, con el tiempo, podría causar coagulación: partículas que se adhieren debido a la atracción eléctrica relativamente débil que se produce mediante las fuerzas de van der Waals. A medida que las partículas se coagulan, el coloide puede desestabilizarse, lo que no es un resultado conveniente. Entonces, ¿cómo contrarrestan los químicos la atracción de van der Waals?
Existen dos métodos principales para prevenir la coagulación, que analizaremos a continuación.
Estabilidad electrostática
La magnitud de esta repulsión depende de dos variables: la densidad de carga en las superficies de las partículas y el medio que las rodea. Por ejemplo, la adición de un electrolito (como la sal) puede comenzar a disminuir la repulsión electrostática hasta que la atracción de van der Waals pueda retomar el control y agrupar las partículas coloidales. Con el tiempo, esto puede causar que la dispersión se torne inestable. En el caso de las partículas con carga negativa, este efecto aumenta considerablemente cuando se agregan electrolitos con cationes multivalentes, como Ca+2, Al+3 y Fe+3, al medio.
Los químicos se basan en lo que se denomina potencial zeta como un indicador de estabilización electrostática. La magnitud del potencial zeta es directamente proporcional al grado de repulsión electrostática entre partículas adyacentes y con cargas similares en una dispersión. En el caso de las moléculas y partículas muy pequeñas, un potencial zeta alto es un marcador confiable de estabilidad coloidal. Un potencial zeta bajo, generalmente, indica inestabilidad y un mayor riesgo de coagulación.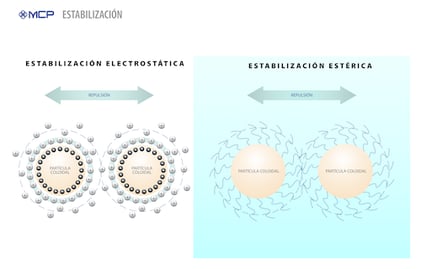
Estabilización estérica
La segunda forma de combatir la coagulación implica un mecanismo denominado estabilización estérica. Estérico es un término que describe cómo están dispuestos los átomos en el espacio tridimensional, que es similar al concepto de espacialidad. En las dispersiones coloidales, por lo tanto, la estabilización estérica hace referencia a la modificación de la superficie de las partículas coloidales de manera que extiendan las estructuras moleculares enlazadas hasta la fase continua por encima de la partícula. Estas extensiones evitan físicamente la aproximación entre dos partículas.
Los químicos inducen la estabilización estérica al agregar diversos ingredientes al medio que “decoran” o cubren las partículas coloidales. Estos ingredientes incluyen una serie de sustancias químicas, aunque habitualmente se usan surfactantes no iónicos con cadenas afines al agua. Estos aditivos se adhieren a las partículas, lo que produce una capa adsorbida con un espesor determinado. Cuando dos partículas se aproximan lo suficiente, las capas adsorbidas pueden superponerse o comprimirse, lo que genera una fuerza repulsiva intensa. Es esta repulsión la que separa las partículas y promueve la estabilidad.
En determinadas ocasiones, las moléculas estabilizadoras permanecen a la deriva y se asientan entre las partículas coloidales. Incluso en esta configuración, continúan impidiendo la aproximación de las partículas y, en consecuencia, evitan que se produzca la coagulación.
Iónico versus estérico
La estabilidad es un concepto importante en la producción y el uso de látex, un delicado equilibrio de fuerzas atractivas y repulsivas, y la forma en que los químicos logran la estabilización se convierte en una herramienta importante dentro de su equipo de trabajo. La estabilidad afecta el rendimiento del látex; demasiada estabilidad iónica o estérica puede impedir la adhesión, la aceptación de material de relleno o la formación de película. Una estabilidad iónica o estérica demasiado baja puede provocar que el látex no permanezca disperso hasta el momento de la aplicación. La siguiente tabla resume algunas de las diferencias clave entre la estabilización aniónica y estérica:
|
Característica |
Estabilización iónica |
Estabilización estérica |
|
Causada por cargas electrostáticas |
Sí |
No |
|
Efectos de la dilución |
No se ve afectada si la carga se une covalentemente al polímero |
Puede producirse desestabilización en altas diluciones de látex |
|
Efectos de las especies catiónicas (con carga positiva) |
Se ve desestabilizada por especies catiónicas |
Falta de sensibilidad a los cationes |
|
Efectos del pH |
Mayor estabilidad cuanto más elevado sea el pH |
Falta de sensibilidad al pH del látex, a menos que el surfactante estabilizador sea sensible al pH |
El equipo de Mallard Creek Polymers puede ayudarlo a decodificar todos los aspectos de la fabricación de látex, incluida la estabilización. Trabajamos con su equipo para analizar las necesidades únicas de su aplicación y luego determinar un programa químico que permita la elaboración de un producto terminado que satisfaga esas necesidades. Llámenos hoy mismo para hablar sobre su próximo proyecto.
Asegúrese de revisar los demás artículos en nuestra serie Latex 101:

 Construction
Construction
 Nonwovens
Nonwovens
 Adhesives
Adhesives
 Textiles
Textiles
 Printing & Packaging
Printing & Packaging
 Paper
Paper
 Paints & Coatings
Paints & Coatings






